
印度仿制药企业崛起的经验与教训(上)
望商君虽去,但秦律犹存
(本文约4000字,共19幅图表,预计阅读时间15至20分钟)
(本文章由澜亭资本-菩提院原创,未经允许请勿转载)
第一部分:
中印差距思考
印度,中国制药企业的国际化初恋。几乎每一位中国制药人都听说过、了解过印度,对印度有爱有恨有夹杂着嫉妒的鄙夷;同时,具有前瞻性的中国制药人对印度亦有崇敬有企盼。记得数年前我刚踏入制药行业,我在这个行业的第一位合伙人彼时仍是中国老牌国企北美总经理,他说:身在制药行业,怎么会没去过印度?这个从中国需飞越世界屋脊才能到达的神秘国度,在大多数人看来是落后与神奇的结合。我们也或多或少听过,IT与制药是印度两大支柱产业。如今,中国在IT行业已经全面超越印度,令印度难望项背;而制药行业却完全是另一番光景。
举例而言,美国仿制药处方量排名前20的制药企业中,9家是印度企业,0家是中国企业(数据来源:Nesta、医药魔方)。好不容易挤进美国市场的中国药企大多只能贴着美国合作伙伴的品牌完成销售,他们在国内向股民、同行打着制剂国际化的旗号,在美国干着CMO的事实,确实也是酸甜苦辣咸五味杂陈。印度制药企业在美国有实实在在的销量,而中国制药企业的制剂国际化大多仅仅停留在“某某药企获得美国ANDA文号若干”便没了下文,其国际影响力更是无从谈起。
印度制药企业全球江湖地位如图1、图2。
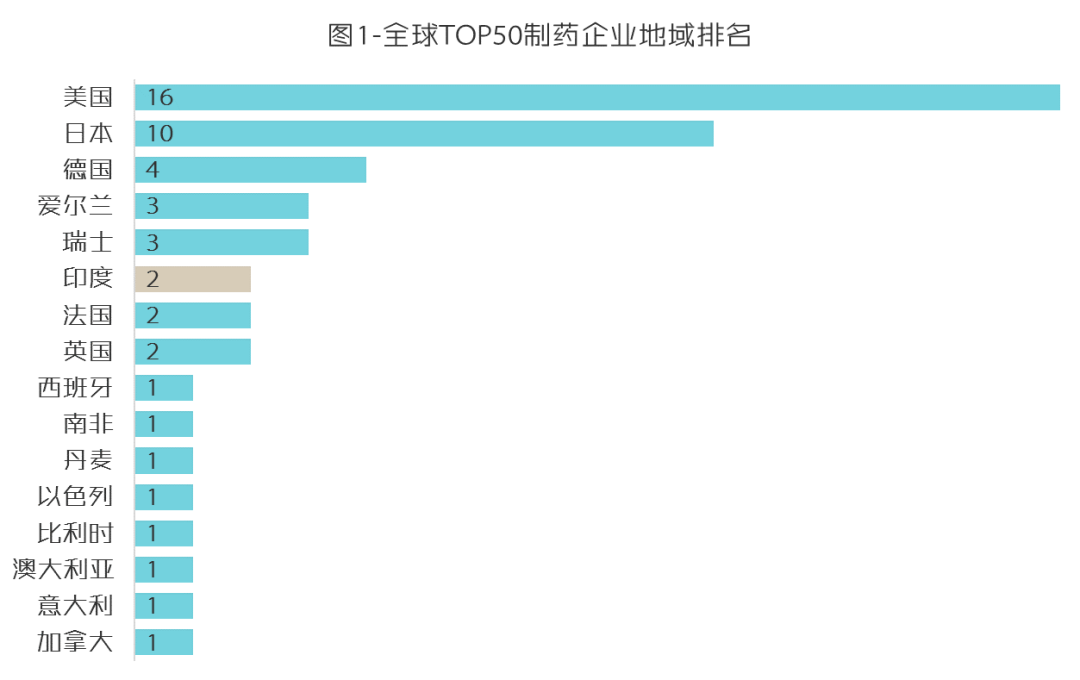 (数据来源:PharmaExec)
(数据来源:PharmaExec)
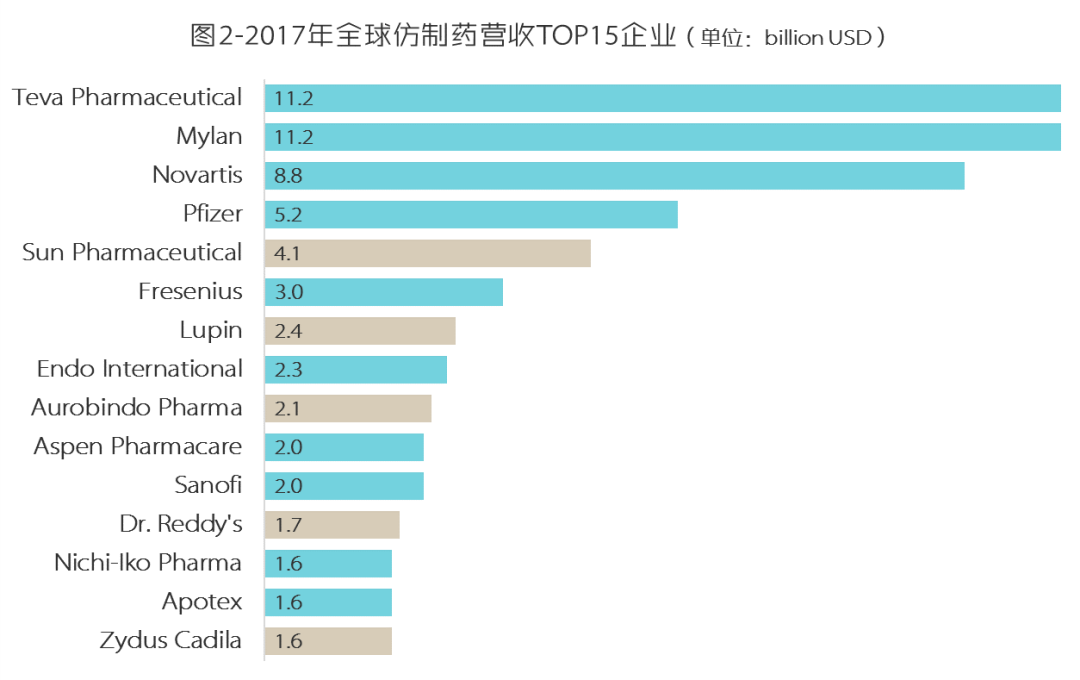
(香槟色为印度企业)
(数据来源:Evaluate Pharma)
印度制药企业进入美国市场的时间点如表1。

(数据来源:各公司官网及公告)
第二部分:
印度药企国际化思考
一个行业的成功既要行业内企业不懈的努力,也需要依靠大背景的支持。国内基础、国际机遇、主观能动无疑是印度药企得以崛起的三大因素。同时仿制药行业本身的特点:质量、价格、速度三边围绕政策一个核心的发展模型也被印度药企修炼得天人合一,结合印度制药企业合理的海外并购节奏,将“主观能动性”这一点发挥到了中国药企迄今难以企及的高度。
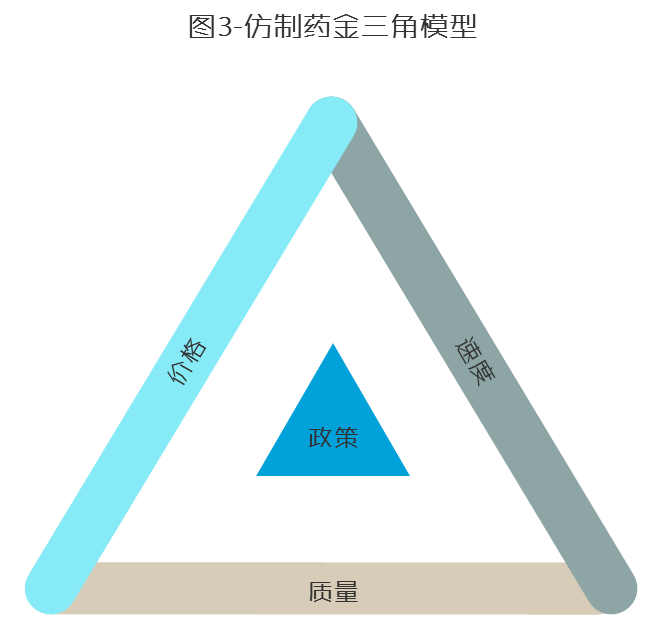
质量方面,印度制药企业一方面得天独厚承袭国际大型制药企业体系,一方面又很好延续了国际药企重视质量体系尤其是文件管理体系的建设与维护的特点,对比中国制药企业往往对硬件重视有余,对软件却照看不足。撰写本文时我曾与一位熟悉国际仿制药行业的专家做过探讨,他说以数据为证:印度制药企业素来谙熟国际药政,擅长接轨国际质量体系,有超过800家通过WHO认证,DMF申报数量一度超过全美数量的三分之一;而中国通过欧盟与美国认证的制药企业加起来不超过100家,印度的数量是我们的五倍。通过进一步调查我们发现,仅2009年,WHO采购目录中就有194款印度生产的药物,而中国制药企业同期给出的答卷是6款。
价格方面,印度77%的制药企业从事制剂生产,近80%的API及中间体进口自中国。而印度有超过60%的制剂销往海外,近40%销往美国。如果说印度是世界药房,那么中国就是世界药房的化工厂。中国生产的API在印度到岸价往往比印度本土生产的同类品种低15-20%,这使得大多数印度API生产商及FDF生产商选择从中国进口中间体及API。印度制药企业熟悉国际市场质量体系,熟悉国际市场销售体系,以此为基础,发挥比较优势,紧密结合中国原料生产商,形成了成本管控相当严格的供应链体系。以甾体激素为例,一款表皮消炎用原料药销售至美国的价格约为2600美金每千克,而销售至印度的价格不到500美金每千克,而这类差价只是冰山一角,上百倍差价也不足为奇。对于中国原料生产企业而言,因为印度客户采购量可观而需要争取,又因为印度客户价格导向斤斤计较而怨声载道。
速度方面,印度制药企业熟悉欧盟、美国的监管、市场规则,一年可以报批近50款品种。同时印度当地政策也为“印度速度”铺就康庄大道。在印度按标准建API工厂,6个月可获批邦(省)级GMP,12个月内可获批国家级GMP,15至18个月可获批cGMP。据在印度实地操作项目的经验,一间可生产4个品种的cGMP标准API车间只需投入200万美元,一年内就可实现商业批生产,其中印度本地对API的GMP只要求一步化学反应,FDA要求三步化学反应。这也是越来越多印度制药企业在中国采购的原料品种开始向上游迁移的原因:一方面为了提高速度,一方面为了进一步缩减成本,还有一方面为了加强质量管控。总结而言,都是围绕“仿制药金三角模型”加强其国际竞争力。
写到这里,我不禁为中国制药企业尤其是原料企业捏一把汗。欧美客户遭印度药企围攻,印度客户又向上游侵袭,如不加速转型升级,未来道路着实艰辛。
再看印度国内基础,自1970年开始,通过出台一系列政策拉开了印度制药行业“站起来”的序幕(见表2)。
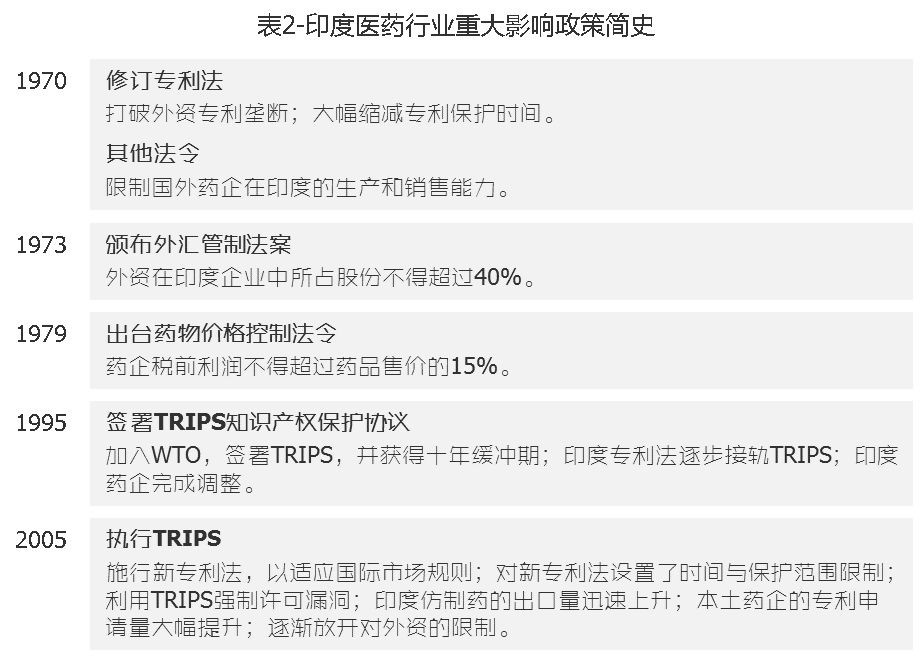
其中,限制外资控股的外汇管制法案可以看做是“斗地主抢田地”式政策。由此很多原本在跨国医药巨头工作的印度技术人才或离开原工作独立创业,或摇身一变接手原来工作的企业成为老板。因此我们可以说,大部分这一阶段发展起来的印度药企都有着国际药企的血统,来源于国际药企的他们在重新接轨国际时有着先天优势。相比之下,大多中国药企的发家史更像泥腿子摸石头过河,高下立判。
再来看国际机遇,由于印度药企的主创人员大多来源于国际药企,因此这部分企业在迈开国际化的第一步时得心应手,很快被纳入WHO采购体系,印度逐渐发展为世界药房。有了WHO这一大体量客户,印度药企解决了生产型企业生存的核心问题之一:成本摊销。吃饱不愁之后,印度药企这才有资格做一做当上国际药企CEO迎娶白富美走上人生巅峰的美梦。
不愁吃喝,手头又有了真金白银的印度药企开始瞄准星辰大海:利润、市场都更诱人的高端国际市场,以及高端市场里的高端技术。同时除了海外并购,印度药企并没有放过国内同行。大量同业间垂直、水平整合造就了印度国内制药行业格局,而以此为基础,印度药企得以实现对欧美白富美上下其手的计划。
同时,印度药企除了能做好药品,也能做好并购。实际上,国际大型制药企业无不是依靠并购发展起来。拉开中国制药企业与印度同行差距的真正原因恰是这一环节,尤其是国际并购理念上两国企业更是相去甚远。印度药企一直是胸怀祖国放眼世界,而大多数中国药企则是眼里有两位丽人,一位是祖国,另一位还是祖国。在与包括Dr. Reddy、Cipla、Lupin等印度知名药企的高管进行深入沟通的基础上,我发现中印药企在海外并购理念上的重要差异:印度企业认为国际并购是去获得,而中国药企却害怕国际并购会造成失去。印度企业家谈论的的是收购一家国际药企能获得什么,而中国企业家考虑的是做一个海外并购怎么控制。这或许是游牧文明与农耕文明的核心差异所在。我认为一个成功的海外并购,首先要给予的是对本地团队的支持和信任,不能马上派驻本国高层监管团队。古人云以夷制夷,现在说本地化,说的就是这个道理。
(数据来源:各公司官网及公告)
(数据来源:各公司官网及公告)
当然,印度制药企业快速崛起并实现国际化的过程中既有经验值得借鉴,又有教训须吸取。比如印度制药企业将“投石问路,步步为营”策略发挥到炉火纯青。不少印度制药企业以API为切入点,进入美国市场,进而以API为基础拓宽至制剂生产合作(CMO),而后从美国引进技术。80年代末期至千禧年前后,印度掀起制药科学家归国潮,大批海归印度科学家或商业人士帮助印度药企进一步获取美国的市场信息及产品技术。紧接着,印度制药企业的美国办公室或小型实验室开始如雨后春笋般冒出。依托于这些实验室,印度药企得以将其API转化为ANDA,从而提高了与美国制药企业的合作层次,并为进一步消化美国市场信息与产品技术打下更扎实的基础。在小心翼翼完成从印度到美国的这关键一步后,印度制药企业利用自身API的优势,借助美国鼓励仿制药的政策,大打价格战和品种战。形成数家同时申报“FTF”、“P-IV”等类型的激烈竞争局面。在逐渐蚕食美国市场的同时,印度药企不再满足于自己缓慢研发,转而甩出支票瞄准美国中小型仿制药企业,完成了从出口API到制剂加工合作到技术引进消化,再到蓄势争夺市场并最终实现收购美国企业的战略性进展。中国现在海归制药科学家日渐增多可谓是印度的昨日重现。而对比中国药企近年来的海外收购,我们看到的却多是“好大喜功”和“急躁冒进”。
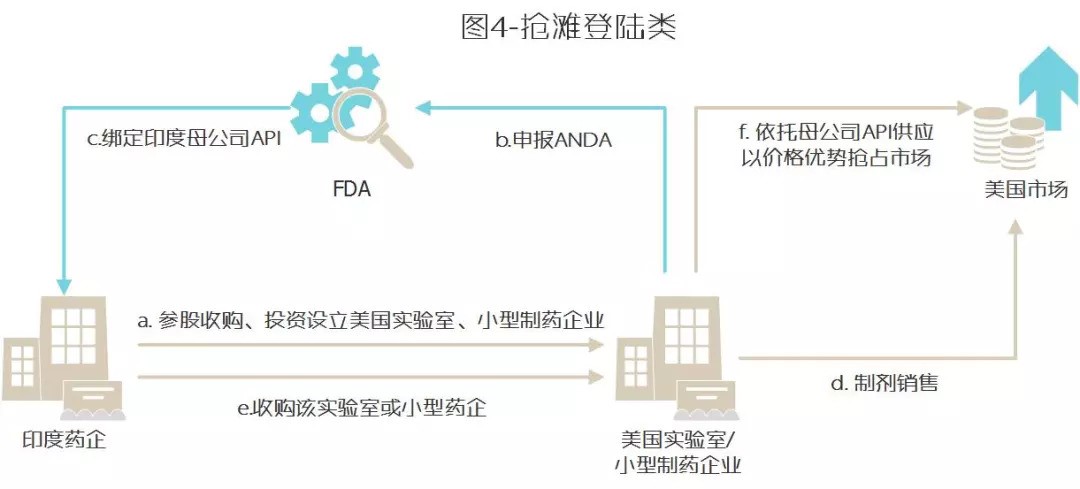
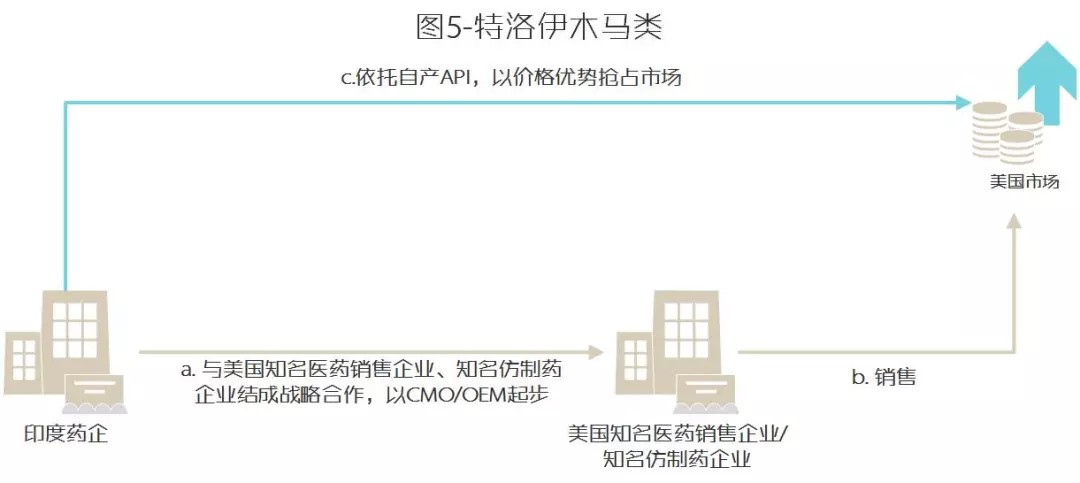
以印度药企进入美国而言,总结有三类模式:抢滩登陆类、特洛伊木马类、兼并进入类。
印度药企进入美国流程图:
A 抢滩登陆类
1. 收购、投资设立美国实验室、小型制药企业(beachhead)
2. 在该实验室或小型制药企业完成ANDA申报,并绑定印度母公司API
3. 实现ANDA申报并完成销售
4. 印度母公司收购该实验室或小型药企,完成品牌转化
5. 借助API优势,进行价格战攻占市场
B 特洛伊木马类
1. 与美国知名医药销售企业、知名仿制药企业结成战略合作,从CMO、OEM起步
2. 熟悉美国销售模式后以控制API为战略优势打价格战攻占市场
C 兼并进入类
1. 直接完成对美国当地知名制药企业的并购,一步到位获得技术、产品与市场
2. 借助API优势,进行价格战攻占市场
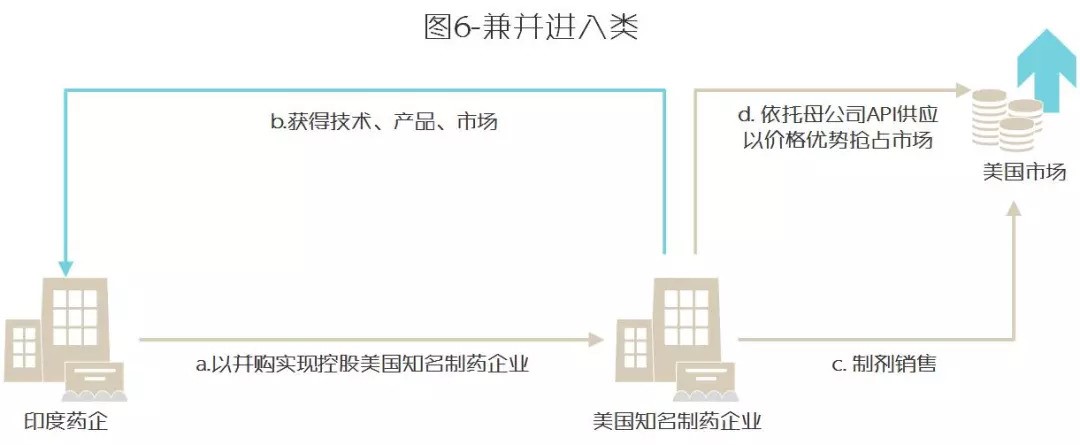
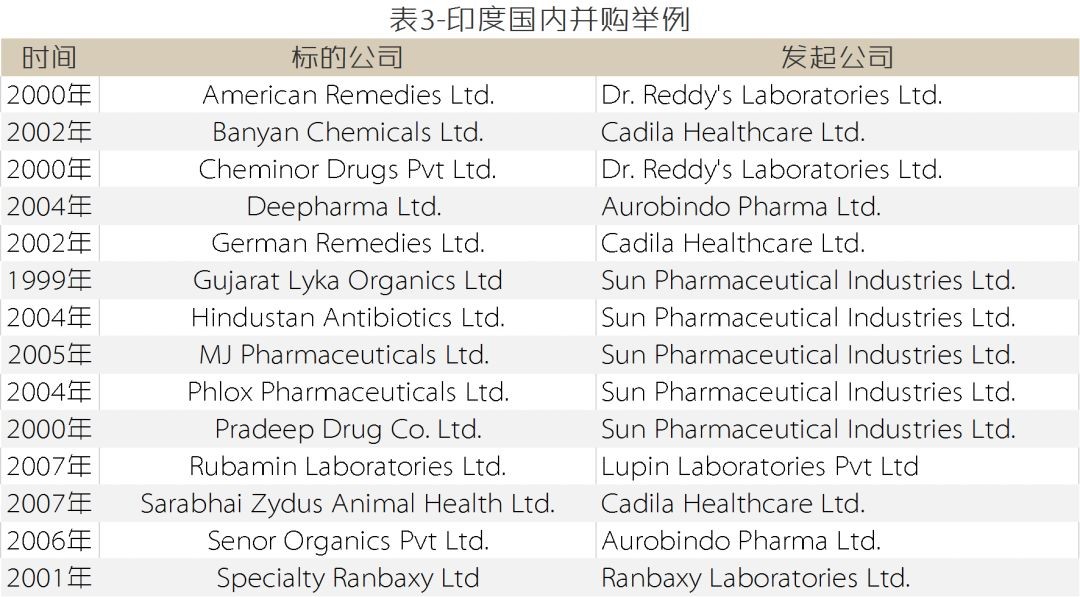
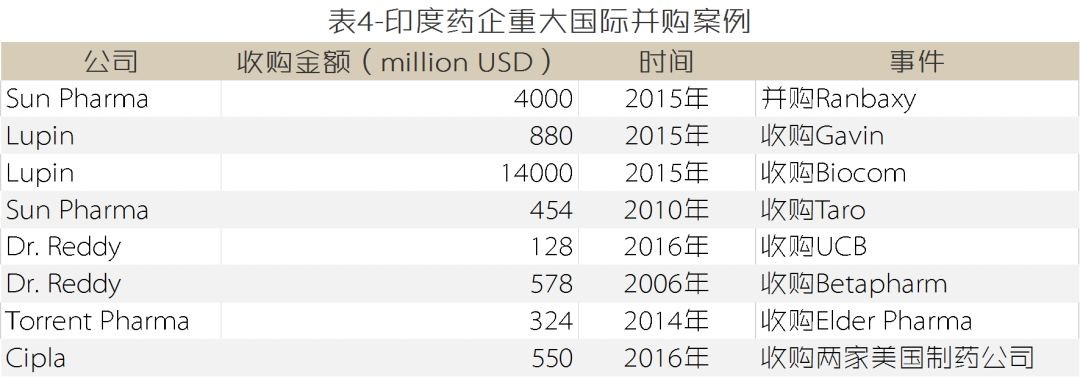
印度企业“投石问路,步步为营”的策略表现为:在各自发展的初期均以抢滩登陆类或特洛伊木马类两种模式为主,积累经验后转为以兼并进入类为主的跨越式发展模式(详见表5-12)。








(表5-12数据来源:各公司官网及公告)
从中我们可以明显总结出印度制药企业最终的策略都是以低价洪水般冲洗美国市场,而印度药企之所以可以实施该策略是因为大部分印度制药企业都是从API到FDF的完整产业链企业,有了API作为支撑,印度制药企业可以做到在盈利点上东边不亮西边亮,进而以最简单的方式抢夺市场。但也正是这一策略为印度药企最近几年所面临困境埋下了伏笔。
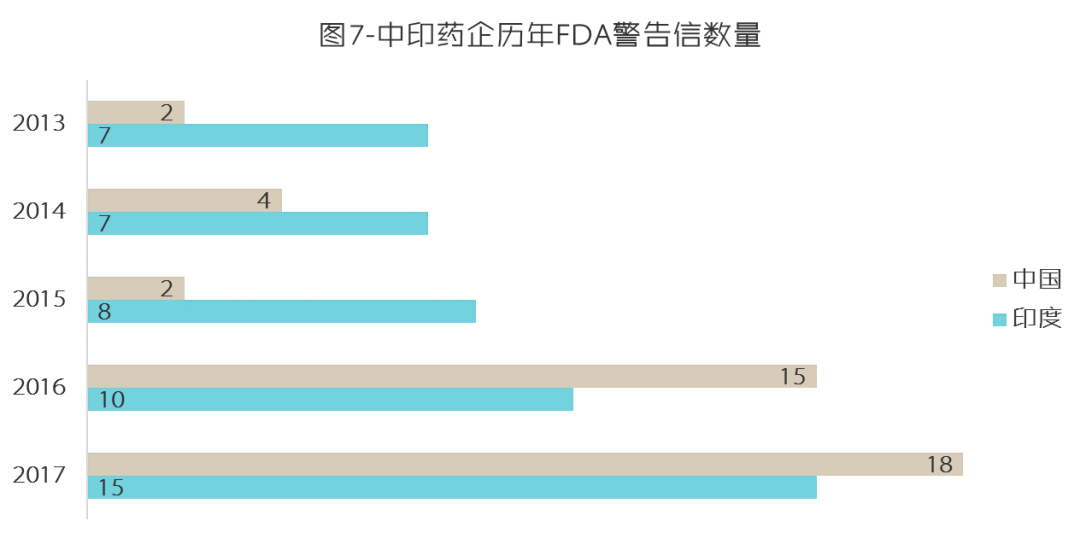
(数据来源:FDA官网)
熟悉美国FDA的读者应该了解,FDA与美国产业界有着非常紧密的联系,不少人在FDA与企业间来回任职。当印度药企洪水猛兽般冲击美国仿制药市场时,开心的是政府和保险公司,而不开心的当然是被动了奶酪的既得利益者。如果将美国比作佛山,那印度就是来踢馆的外乡人。俗话说,武艺再高也怕菜刀,FDA的警告信就是美国制药企业握在手里的菜刀。俗话还说打铁还需自身硬,印度制药企业短短几年内“喜提”47封警告信的灿烂业绩应当被正在国际化进程中的中国药企引以为戒,只可惜就目前数据来看,中国药企虽然在销量上和印度药企还有很大差距,但在警告信上却已实现了超越。无论如何,进入美国市场,需谨记双拳难敌四手,如何在别人的地头上按照江湖规矩把事情办好,是中国药企需要思考的。
我们认为闭门造车实不可取,印度制药行业在过去三十年去的的成绩与经历过的波折值得我们持续性挖掘与思考。目前世界制药行业格局正发生着一系列变化,大型并购仍时有发生。虽然毕局长辞任,但我们由衷希望他在任时推动的医药改革这一沉重历史车轮能持续前行,中国药企也应当抓住这一历史转折点,努力自我奋斗,争取早日真正实现超印赶美。
下期预告:
中国制药企业应当如何实现对印度同行的追赶乃至超越?请期待澜亭医药研报“印度仿制药企业崛起的经验与教训(下)”。下期内容中,我们将围绕客观原因:人才因素、行业因素、产业因素以及政策因素进一步剖析中印差距成因;我们也将分析中国仿制药企业如何应用“仿制药金三角模型”对印度药企实现追赶以及在此基础上如何通过创新及投并购实现对印度制药企业的超越。

免责声明
“本公众号”指由杭州澜亭投资管理有限公司(以下简称“本公司”)注册并负责运营的公众号“澜亭序(LanTingResearch)”及其本公众号内所发布的所有信息及材料。
1. 本公众号所载信息和资料的来源皆由本公司审核,且本公司尽力严谨处理本公众号所载信息和资料,但本公司的审核仅限于信息与资料的表面审核,并不构成本公司对其准确性、充分性、完整性及其使用的适当性等的任何保证;本公司及其股东、员工不对本公众号内第三者所提供资料的任何错误或遗漏承担任何法律责任,投资者应自行承担依据本公众号资料与信息所作决策的所有风险。
2. 您理解并确认,本公众号所登载信息与资料具有时效性,您在阅读资料或信息的时间与资料或信息有可能因所基于的资料或信息发布日之后的情势或其他因素的变更而不再准确或失效。本公众号不对您由于本公众号所登载信息与资料的时效性所作决策承担任何法律责任。
3. 您理解并确认,本公众号为向用户提供便利而设置的外部链接网页(如有)的内容并非由本公司实际控制,本公司会对该外部链接功能进行定期检查,但本公司不能保证其所载入信息的真实性、准确性、充分性、完整性和时效性,同时,亦不应视为本公司同意、推荐、认可、保证或推介任何第三方或其网站所提供的服务/产品,您须自行识别、判断该等网站信息的可靠性。
4. 您理解并确认,本公众号介绍的信息和资料并非旨在提供任何形式的建议(包括但不限于投资、税收、会计或法律等的建议)。这些信息和资料仅供一般性参考,不应被视为购买或销售任何金融产品的某种要约,亦并不构成本公司对任何金融产品投资收益的保证。
5. 您理解并确认,未经本公司书面许可,您或您所代表的机构不得转载和发布本网站内的任何信息。
6. 除非存在故意不当或欺诈行为,本公司及其股东、员工对于因您进入、访问或使用本公众号,或无法进入、访问或使用公众号而可能对您导致的任何直接或间接损失,不承担任何责任。

